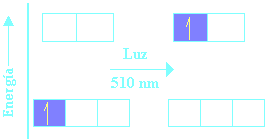
La absorción de luz se debe a la transición
T2g1 eg0 ---> t2g0eg1 cuyo máximo se presenta en 20,300 cm-1
20300 x 1 kJ mol-1/83.6 cm-1 = 243 kJ mol-1

La diferencia entre los orbitales t2g y eg se define como 10Dq, la energía de los orbitales t2g con respecto al baricentro de los orbitales d sin perturbar es -4Dq. En el caso d1 que se discutió la energía de estabilización del campo cristalino (EECC) es -4Dq.
El acomodo de los electrones sigue la regla de Hund, es decir, permanecen desapareados y entran en diferentes orbitales degenerados.
Cuando se llega a la configuración d4, hay dos posibilidades que el electrón entre en t2g o en eg:
EECC = (3 * -4Dq) + (1 * +6Dq) = -6Dq

Efectos de campo cristalino para campos fuertes y débiles en complejos octaédricos
| electrones d | Configuración | Electrones desapareados | EECC |
| 1 | t2g1 | 1 | -4Dq |
| 2 | t2g2 | 2 | -8Dq |
| 3 | t2g3 | 3 | -12Dq |
| 4 | t2g3eg1 | 4 | -6Dq |
| 5 | t2g3eg2 | 5 | 0Dq |
| 6 | t2g4eg2 | 4 | -4Dq |
| 7 | t2g5eg2 | 3 | --8Dq |
| 8 | t2g6eg2 | 2 | -12Dq |
| 9 | t2g6eg3 | 1 | -6Dq |
| 10 | t2g6eg4 | 0 | 0Dq |
| electrones d | Configuración | Electrones desapareados | EECC |
| 1 | t2g1 | 1 | -4Dq |
| 2 | t2g2 | 2 | -8Dq |
| 3 | t2g3 | 3 | -12Dq |
| 4 | t2g4 | 2 | -16Dq+P |
| 5 | t2g5 | 1 | -20Dq+2P |
| 6 | t2g6 | 0 | -24Dq+2P |
| 7 | t2g6eg1 | 1 | -18Dq+P |
| 8 | t2g6eg2 | 2 | -12Dq |
| 9 | t2g6eg3 | 1 | -6Dq |
| 10 | t2g6eg4 | 0 | 0Dq |
d5: EECC = (5 x -4Dq) + (2 x +P) = -20Dq+2P
d6: EECC = (6 x -4Dq) + (2 x +P) = -24Dq+2P
Si resulta confuso el cálculo de energías de apareamiento es dado que el número no es el resultado de los pares de electrones, sino que es el cambio en apareamiento con respecto al campo débil.
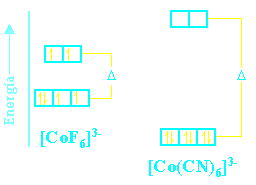
El complejo [CoF6]3- se describe como un complejo de espín alto; es decir, los electrones están dispuestos de manera que puedan permanecer no apareados hasta donde sea posible. Por otra parte, el ion [Co(CN)6]3- se describe como un complejo de espín bajo. Estas dos disposiciones electrónicas distintas se pueden distinguir fácilmente si se miden las propiedades magnéticas del complejo, como ya se ha descrito. El espectro de absorción también muestra rasgos característicos que indican la disposición de los electrones.
Imagine ocho ligantes que se aproximan al átomo metálico central alineados en las esquinas de un cubo.
El esquema de energía para la simetría cúbica es exactamente el inverso que para la simetría octaédrica.
| electrones d | Configuración | Electrones desapareados | EECC |
| 1 | e1 | 1 | -6Dq |
| 2 | e2 | 2 | -12Dq |
| 3 | e2t21 | 3 | -12Dq |
| 4 | e2t22 | 4 | -6Dq |
| 5 | e2t23 | 5 | 0Dq |
| 6 | e3t23 | 4 | -4Dq |
| 7 | e4t23 | 3 | -8Dq |
| 8 | e4t24 | 2 | -12Dq |
| 9 | e4t25 | 1 | -6Dq |
| 10 | e4t26 | 0 | 0Dq |
| RUPTURA DE LA DEGENERACIÓN DE LOS ORBITALES "d" EN DIVERSOS ENTORNOS DEL METAL CENTRAL | ||||||
| Número Coordinación | Estructura | dx2-y2 | dx2 | dyz | dxz | dxy |
| 2 | Lineal | -0.314 | 0.514 | -0.314 | 0.057 | 0.057 |
| 3 | Triangular | -0.628 | 1.028 | -0.628 | 0.114 | 0.114 |
| 4 | Tetraedro | -0.267 | -0.267 | 0.178 | 0.178 | 0.178 |
| 4 | Cuadrado | 1.228 | -0.428 | 0.228 | -0.514 | -0.514 |
| 5 | Bipirámide Trigonal | -0.082 | 0.707 | -0.082 | -0.272 | -0.272 |
| 5 | Pirámide Cuadrada | 0.914 | 0.086 | -0.086 | -0.457 | -0.457 |
| 6 | Octaédro | 0.600 | 0.600 | -0.400 | -0.400 | -0.400 |
| 7 | Bipirámide Pentagonal | 0.282 | 0.493 | 0.282 | -0.528 | -0.528 |
La diferencia en energía entre la configuración de bajo espín y de alto espín la "energía de apareamiento" está compuesta por dos términos:
La repulsión inherente que se presenta cuando se fuerza a dos electrones a ocupar el mismo orbital
La pérdida de energía de intercambio que se presenta cuando dos electrones con espines paralelos se fuerzan a que tengan espines antiparalelos. La energía de intercambio es proporcional al número de pares de electrones del mismo spín que pueden acomodarse a partir de n electrones paralelos
Las transiciones de alto espín a bajo espín se pueden ver gráficamente como se muestra en la siguiente figura. El aumento de la fuerza del campo tiene como resultado un incremento en la estabilización de todas las configuraciones d1 a d9 excepto d5. La pendiente de las líneas de energía está determinada por la EECC que es siempre mayor para el caso de campo fuerte que para el campo débil. En algún valor de la fuerza del campo (10Dqx) las energías de los dos estados son iguales. Para campos más débiles, a la izquierda del punto de cruce, el estado de alto espín se favorece, mientras que a la derecha es más estable el de bajo espín.
| Energías de apareamiento para algunos iones 3d KJ mol-1 | ||||
| Ión | Pcoul Energía Coulombica | Pex Energía de Intercambio | PT Energía Total |
|
| d4 | Cr2+ Mn3+ | 71.2 87.9 | 173.1 213.7 | 244.3 301.6 |
| d5 | Cr+ Mn2+ Fe3+ | 67.3 91.0 120.2 | 144.3 194.0 237.1 | 211.6 285.0 357.4 |
| d6 | Mn+ Fe2+ Co3+ | 73.5 89.2 113.0 | 100.6 139.8 169.6 | 174.2 229.1 282.6 |
| d7 | Fe+ | 87.9 100 | 123.6 150 | 211.5 250 |
| Ion | 10 Dq (Oh) | 10 Dq (Td) |
cm-1 |
| Cr2+ | 1400 | 620 |
| Mn3+ | 2100 | 930 |
Note que hay una progresión sucesiva en la frecuencia de absorción de los máximos conforme cambia el átomo unido al metal en los ligantes de la forma
Cl?S?O?N?C, lo que corresponde a un aumento progresivo en el valor de 10Dq.
En general es posible enlistar a los ligantes en orden de la fuerza del campo en la serie espectroquímica.
A pesar de que no es posible formar una serie espectroquímica completa de todos los ligantes con un ion metálico, es posible construir una a partir de secuencias que se traslapan:
| 10Dq kJ mol-1 |
|||
| [CrCl6]3- | 158 | [Co(H2O)6]3+ | 218 |
| [MoCl6]3- | 230 | [Rh(H2O)6]3+ | 323 |