
Se ha definido la velocidad de una reacción en términos de concentraciones, órdenes y constantes de velocidad. Enseguida se considerará el comportamiento con respecto al tiempo de la concentración de los reactivos en reacciones elementales con órdenes simples. El comportamiento con respecto al tiempo se determina integrando la ley de velocidad para una expresión de velocidad particular.

Las reacciones de orden cero se encuentran más frecuentemente en reacciones heterogéneas en superficies. La velocidad de reacción en este caso es independiente de la concentración de la sustancia reactiva. Para encontrar el comportamiento con el tiempo de esta reacción, la ecuación (7) se escribe en la forma diferencial (8)

 (9)
(9)
 (10)
(10)
 (11)
(11)
Una reacción de primer orden es aquélla en la que la velocidad de reacción depende únicamente de un reactivo.
Por ejemplo, la isomerización de isocianuro de metilo, CH3NC: CH3NC => CH3CN
Este tipo de reacciones se pueden representar como A => B; la velocidad de desaparición de A se puede escribir de la siguiente manera:
 (12)
(12) (13)
(13)
Para resolver la ecuación diferencial se separan las variables y se integra:
 (14)
(14)
 (15)
(15)Si se aplican las condiciones a la frontera, de forma que para t=0 para el tiempo inicial, el valor de A es [A]0, se puede eliminar la constante de integración de la ecuación (15):
 (16)
(16)
 (17)
(17)
 (18)
(18)Por lo que en la ecuación (15):
 (19)
(19)La ecuación (18) se puede escribir en varias formas. Algunas de las más comunes son:
 (20)
(20) (21)
(21) (21) una gráfica semilogarítmica de [A]t contra t dará una línea recta cuya pendiente es k/2.303 y la ordenada al origen es [A]0.
(21) una gráfica semilogarítmica de [A]t contra t dará una línea recta cuya pendiente es k/2.303 y la ordenada al origen es [A]0.
Hay dos casos de cinéticas de segundo orden. El primer caso es una reacción entre dos especies idénticas:
 (22)
(22) El segundo caso es una reacción global de segundo orden entre dos especies diferentes:
En este caso la reacción es de primer orden con respecto a cada uno de los reactivos
 (23)
(23) (24)
(24)
 (27)
(27)
Una gráfica del inverso de la concentración de A contra tiempo debe dar una línea recta de pendiente igual a 2k y ordenada al origen 1/[A]0.
Para integrar la ley de velocidad del segundo caso, es definir una variable del progreso de la reacción x, de la siguiente manera:
 (28)
(28)
donde [A] 0 y [B] 0 son las concentraciones iniciales. La expresión de velocidad definida por la ecuación (23) se puede rescribir en términos de x de la siguiente manera:
 (29)
(29)
Se integra entre límites:
 (30)
(30)Para resolver la integral del lado izquierdo de la ecuación (30) se separan las variables y se utiliza el método de las fracciones parciales:
 (31)
(31)
 (32)
(32)
En el primer caso la ley de velocidad depende de la tercera potencia de un reactivo:
 (33)
(33)
Esta ley de velocidad se puede integrar fácilmente para obtener la solución:
 (34)
(34)
 (35)
(35)Una gráfica del inverso del cuadrado de la concentración de A contra t debe dar una línea recta de pendiente igual a 6k y ordenada al origen 1/[A]02.
El segundo caso es una reacción de segundo orden con respecto a A y primer orden con respecto a B. La ley de velocidad es:
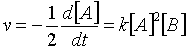 (36)
(36)
Una forma fácil de integrar la ecuación (36) es cuando las concentraciones iniciales de A y B son iguales. Al integrar la ley de velocidad para este caso, es conveniente introducir una variable de progreso, en forma semejante a lo que se hizo para las reacciones de segundo orden. Se define una variable de progreso y:
y con esta condición podemos rescribir la ecuación (36) en términos de y:
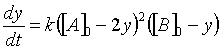 (37)
(37)Reacomodando
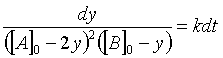 (38)
(38)Integrando por fracciones parciales
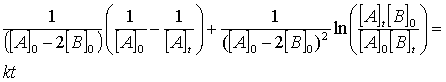 (39)
(39)El tercer caso es cuando se tiene una reacción que tiene dependencia de primer orden en cada uno de los componentes:
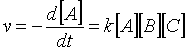 (40)
(40)La integración se lleva a cabo por fracciones parciales y se deja como tarea.
Dos ejemplos que se encuentran en la literatura de reacciones de tercer orden son, por ejemplo, el proceso de recombinación de tres cuerpos, tal como
Otro ejemplo es la reacción en fase gaseosa:
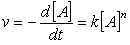 (41)
(41)
Una integración simple de esta expresión da como resultado:
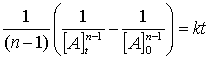 (42)
(42)
que se puede rescribir como:
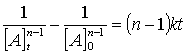 (43)
(43)
La ecuación (43) es válida para cualquier valor excepto n = 1.
En la siguiente figura se muestra una gráfica de concentración contra tiempo para reacciones de diversos órdenes.
*********GRAFICA DE ORDENES*********
En el caso general no hay una gráfica simple que se pueda construir para probar el orden de una reacción, como puede hacerse para los casos de primer y segundo orden.
Cuando se desconoce el orden de una reacción, se puede construir una gráfica de Van’t Hoff como una ayuda para deducirlo.
En una gráfica de Van’t Hoff, se grafica el logaritmo de la velocidad en función del logaritmo de la concentración del reactivo A. Esto es equivalente a hacer una gráfica de la ecuación (43) en papel logarítmico. La pendiente de dicha gráfica nos da el orden n de reacción.
Se muestran algunos ejemplos en la siguiente gráfica.
 (23)
(23)Suponga adicionalmente que la concentración de B se mantiene esencialmente constante durante el periodo de observación del experimento, por lo que la ecuación de velocidad se puede escribir:
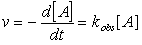 (44)
(44)
en donde