Bağışıklık Sistemi Baskılanmış Hastalarda Pnömoni
Tanı ve Tedavi Rehberi
Toraks Derneği
Solunum Sistemi İnfeksiyonları Çalışma Grubu
Bağışıklık Sistemi Baskılanmış Hastalarda Gelişen Pnömoniler
Alt Çalışma Grubu
Prof. Dr. Eyüp Sabri Uçan (Başkan)
Doç. Dr. Abdullah Sayıner (Sekreter)
Prof. Dr. Hamdi Akan
Prof. Dr. Orhan Arseven
Prof. Dr. AyşeYüce
Doç. Dr. Ünal Açıkel
Doç. Dr. Murat Akova
Doç. Dr. Zeynep Gülay
Doç. Dr. Aydanur Kargı
Doç. Dr. Muhit Özcan
Doç. Dr. Özlem Özdemir
Doç. Dr. Toros Selçuk
Doç. Dr. Levent Tabak
Uzm. Dr. Füsun Alataş
Uzm. Dr. Erdem Silistreli
Uzm. Dr. Celalettin Üstün
Uzm. Dr. Ayşın Zeytinoğlu
Epidemiyoloji ve Sorunun Boyutu
Bağışıklık sistemi baskılanmış olguların sayısı son yıllarda hızla artmaktadır(1). Bunlar: Kemoterapi alan solid tümörlü, hematolojik malignitesi olan, organ transplantasyonu yapılmış, nonmalign hastalıkları nedeniyle kortikosteroid veya kemoterapötik ajan kullanan, doğumsal v
e edinsel olarak (HIV virüs enfeksiyonu gibi) bağışıklığı baskılanmış olan olgulardır (1-3).Bu olgu gruplarında solunum sistemiyle ilgili sorunlar bağışıklık yetmezliğinin, derecesi ve süresiyle ilgili değişik özellikler taşıyarak, oldukça sık, karmaşık ve önemli hayati sorunlar olarak karşımıza çıkmaktadır (1-3).
Bağışıklık sistemi baskılanmış hastalarda (BBH) yeni oluşan pulmoner infiltratların tanısı ve tedavisi genellikle güçlük yaratır. Bu hastalarda akciğer infiltratlarının nedenleri fırsatçı olan ya da olmayan infeksiyonlar, bağışıklık sistemi baskılanmasına doğrudan ya da tedavileri sonucu yol açan hastalıkların akciğerlere yayılımı, bu hastalıklar ya da tedavileri ile ilişkili, fakat bağışıklık sistem baskılanması ile ilişkili olmayan he
moraji, ödem, infarkt, ilaç ve radyasyon toksisitesi gibi patolojiler olabilir (Tablo 1). BBHde çeşitli neden ve oluşum mekanizmaları olan pulmoner komplikasyonların % 75 gibi büyük bir kısmını infeksiyonlar oluşturur. Nötropenik ya da lokal infiltrasyonu olan hastalarda bu oranın % 90’a çıktığı bildirilmektedir. Pulmoner komplikasyonların % 25 kadarını ise infeksiyon dışı patolojiler oluşturmaktadır. Hastaların yaklaşık yarısında birden fazla infeksiyon ajanı ya da infeksiyon ve infeksiyon dışı patolojilerin birlikteliğinin görülmesi (1,4) olayın boyutlarını, tanısal yaklaşım güçlüğünü ortaya koymaktadır. Bu hastalarda % 45 e ulaşan yüksek mortalite oranları bildirilmiştir. Kemik iliği ve böbrek transplantasyonu uygulanmış hastalarda gelişen Aspergillus pnömonisinde % 68-100, HIV (+) olgularda gelişen çok ilaca dirençli tüberkülozda ise % 80 düzeyinde mortalite oranları bildirilmiştir (5-7).Tablo 1’de görüldüğü gibi, infeksiyöz etkenlerin ve infeksiyon dışı nedenlerin çeşitliliği bu olgularda empirik yaklaşımı güçleştirmekte ve multidisipliner yaklaşımı gerekli kılmaktadır. Hastalarda akciğer problemi ortaya çıktığı zaman primer izleyen hekime ek olarak göğüs hastalıkları, infeksiyon hastalıkları, radyoloji, mikrobiyoloji, patoloji, göğüs cerrahisi ve yoğun
bakım uzmanlarından oluşan bir ekibin ortak çabasını gerekmektedir. Bu birlikteliğin sorunun ilk başladığı noktadan sonlanana dek sürdürülmesine özen gösterilmelidir.İnfeksiyöz Nedenler
Bağışıklık sistemi baskılanmış hastalarda görülen pulmoner infeksiyon nedenleri, konaktaki savunma defektinin türüne göre değişmektedir. Diğer yandan, pek çok olguda bu savunma defektlerinin birkaçının bir arada bulunabileceği unutulmamalıdır (Tablo 2). Ayrıca, savunma defektlerini oluşturan primer neden de belirleyici o
labilir. Örneğin, kemik iliği transplant alıcılarında Cytomegalovirus (CMV) infeksiyonu, HIV infeksiyonlularda P. carinii pnömonisi daha sıklıkla görülmektedir.İnfeksiyonun seyri klinisyeni etken konusunda yönlendirebilir. Ani başlangıçlı tablolarda
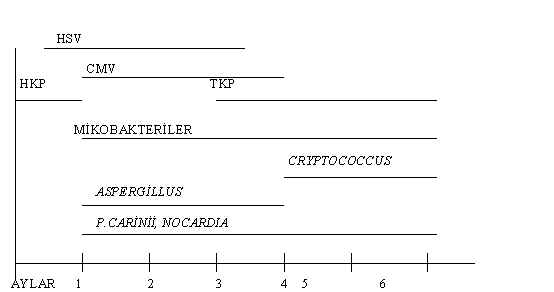
P. carinii ve piyojenik bakteriler, sinsi ve yavaş seyirli durumlarda M. tuberculosis ve Nocardia daha öncelikle akla gelmelidir. Tablo 3’te de izlenebileceği gibi, aynı etken, bağışıklığın baskılanma düzeyine paralel olarak hızlı ya da daha sinsi seyirli infeksiyonlar oluşturabilmektedir.Transplant alıcılarında, infeksiyonun transplantasyon sonrası ortaya çıkış zamanına göre de infeksiyon etkenleri ve infeksiyon dışı süreçler farklılık göstermektedir. Şekil 1’te solid organ transplant alıcılarında transplantasyon sonrası döneme göre akciğer infeksiyonlarının genel dağılımı gösterilmiştir. Bu olgular ilk ay içinde genel olarak hastanede izlendikleri için, bu erken dönemde hastane kökenli infeksiyonlar ön planda görülmektedir.Transplantasyon sonrası 1-6. ayl
ar bağışıklığın baskılanmasının en yoğun olduğu dönemlerdir ve fırsatçı infeksiyonlar (CMV, Aspergillus, vb) bu dönemde daha sık görülmektedir. 6. aydan sonra, olgularda rejeksiyon olup olmamasına, dolayısıyla, uygulanan immünosüpresif sağaltımın yoğunluğuna paralel olarak, toplum kökenli infeksiyon etkenlerinin yanısıra (S. pneumoniae, H. influenzae, influenza virusu vb), fırsatçı patojenler de (Nocardia, M. tuberculosis gibi) etken olabilmektedir.Hematopoetik kök hücre (bu gruba kemik iliği, periferik kan ya da göbek kordon kanı kökenli) transplant alıcılarında da, akciğer komplikasyonlarının ayırıcı tanısı, komplikasyonun ortaya çıkış zamanına göre değişmektedir (Şekil 2). 100. günden önceki komplikasyonlar erken komplikasyonlar olarak nitelenmektedir. A
yrıca, olgunun primer tanısı, transplant öncesi hazırlık döneminde uygulanan tedavi yaklaşımları (uygulanan kemoterapötiklerin yoğunluğu, total vücut ışınlaması alıp almaması), yaşı, graft-versus-host hastalığı (GVHD) varlığı transplantasyonun otolog ya da allogeneik olması komplikasyonların türünü etkilemektedir (5).İnfeksiyon etkenleri arasında bazıları klinik açıdan özellik gösterebilmektedir. BBHde hastane kökenli infeksiyon etkenleri olarak Gram (-) basiller,
P. aeruginosa, Acinetobacter başta olmak üzere, kalıcı intravenöz kateteri olanlarda S. aureus ve koagülaz (-) stafilokoklar görülmektedir. Legionella ve çok ilaca dirençli M. tuberculosis’e bağlı hastane epidemileri bildirilmiştir (8-10). Nocardia infeksiyonları organ transplant alıcılarında ve uzun süreli steroid kullananlarda görülebilir; sıklıkla, kaviteleşebilen, multipl nodüler infiltratlara neden olurlar (11). Doğal olarak, bu olgularda da S. pneumoniae ve H. influenzae gibi etkenlerle toplum kökenli pnömoni gelişebileceği unutulmamalıdır. Toplum ve hastane kökenli pnömonili BBH’lere yaklaşım, hastaneye yatırma kriterleri ilgili kılavuzlarda tartışıldığı gibidir, ancak ayırıcı tanı spektrumu çok geniş olduğu için, bu hastalar genellikle yatırılarak izlenir.Mikobakteriler: BBH’de api
kal tutuluşlu tipik olgular olabileceği gibi, atipik radyografik bulguları olan ya da miliyer patternli olguların da olabileceği akılda tutulmalıdır. Atipik, ekstrapulmoner ve dissemine formlar daha çok immun süpresyonun yoğun olduğu olgularda görülmektedir. Gelişmekte olan diğer ülkelerde olduğu gibi, tüberkülozun endemik olduğu ülkemizde de, aksi kanıtlanana dek, bu hasta grubunda atipik mikobakterilerden çok, M. tuberculosis infeksiyonları öncelikle düşünülmelidir (12,13)P. carinii: Daha önceleri paraz
iter etken olarak bilinen, ancak son yıllarda fungus olduğu kabul edilen (14). P. carinii’ ye bağlı pnömoniler sıklıkla bilateral diffüz interstisyel bulgularla seyretmektedir. Son yıllarda yaygın olarak uygulanan kotrimoksazol profilaksisi ile bu infeksiyonun insidensi belirgin olarak azalmıştır. HIV (+) olgularda radyografinin normal olabileceği ve özellikle pentamidin profilaksisi uygulanan hastalarda atipik radyografik bulgularla ortaya çıkabileceği unutulmamalıdır. Hipoksemi ve serum LDH yüksekliği sık saptanan bulgulardır. CD4 sayısı 200’ ün altında, hipoksemisi olan HIV (+) olgularda, akciğer infiltrasyonu olmaksızın da P. carinii pnömonisi düşünülebilir.CMV: HIV (+) olgularda akciğerlerde primer bir patojen değildir. Buna karşılık, transplant alıcılarında sık görülür, ciddi hastalık tablolarına yol açar ve sıklıkla diğer patojenlerle
(P. carinii, enterik Gram (-) basiller, vb) birlikte bulunmaktadır. CMV infeksiyonu primer ya da latent infeksiyonun reaktivasyonu şeklinde gelişir. Primer infeksiyonun daha ciddi klinik tablolara yol açtığı bildirilmekle birlikte, ülkemizde alıcı ve vericilerdeki yüksek seroprevalans (% 90) nedeniyle, sıklıkla (% 33 – 81) reaktivasyon / reinfeksiyon görülmektedir (15,16).Fungal infeksiyonlar: Candida
infeksiyonu tanısı için doku invazyonunun gösterilmesi gereklidir ve akciğer tutuluşu genellikle fungeminin bir parçası olarak görülür . Aspergillus infeksiyonlarında da tanı temel olarak doku invazyonunun gösterilmesine dayanmakla birlikte, özellikle hematolojik maligniteli ve derin nötropenili olgularda yüksek mortalite ve invaziv girişimlerin güçlüğü nedeniyle, solunum sekresyonlarında Aspergillus saptanması tedavi endikasyonu olarak kabul edilebilir; buna karşılık, Aspergillus saptanmaması tanıyı reddetirmez (17-20). İnvaziv aspergilloziste, semptomatik dönemde olguların 1/3ünde akciğer radyografisi normaldir. BT’de halo belirtisi, kavitasyon gösteren nodüler opasiteler görülmesi tanıyı destekleyen önemli bulgulardır (21,22). BTde halo belirtisi, nodüler bir opasiteyi çevreleyen düşük atenüasyon alanı olarak tanımlanır ve risk grubundaki, yüksek ateşli olgularda erken dönemde, tanıda yüksek duyarlılığı ve özgüllüğü olan bir bulgu olarak kabul edilmektedir.İnfeksiyon dışı nedenler
Tablo 1 de görülen infeksiyon dışı nedenler de, infeksiyonlara benzer tablolara yol açabilir. Ayrıca, infeksiyonlar ve infeksiyon dışı süreçler bir arada bulunabilir ya da infeksiyöz etkenler bazı infeksiyon dışı süreçleri tetikleyebilir.
Öncelikle, akciğer sorununun primer hastalığın (lösemi, lenfoma, bağ dokusu hastalığı) akciğer tutuluşu olabileceği akılda tutulmalıdır. Ayrıca bu hastalıkların tedavisinde kullanılan ilaçlara ve radyoterapiye bağlı da akciğer komplikasyonları gelişebilir.
HIV infeksiyonları dışında uzun süreli immün süpresif tedavi alan olgularda da Kaposi sarkomu gelişebilir ve akciğer tutulumu olabilir. İmmün süpresyonun yoğunluğunun azaltılmasıyla spontan iyileşmeler görülmektedir. Deri lezyonlarının varlığı, hemorajik nitelikte plevral sıvı ve bronş ağ
acı dallanma bölgelerinde mukozadan kabarık, vişne kırmızısı lezyonlar görülebilir. Özellikle deri lezyonlarından tanısı olan olgularda, bronkoskopi sırasında masif hemorajiler gelişme riski nedeniyle biyopsiden kaçınılmalıdır.Akciğer ve kalp-akciğer transplant alıcılarında ve kemik iliği transplantasyonundan sonra kronik GVHD varlığında, irreversibl küçük havayolu obstrüksiyonu ile giden bronşiolitis obliterans gelişebilir ve ciddi bir morbidite, mortalite nedenidir.
Diffüz alveoler hemoraji hemoptizi o
lmaksızın görülebilir. Hematokrit düzeyinin düşmesi, yapılabilirse diffüzyon kapasitesi düzeyinin artması, BAL sıvısı incelemesinde hemosiderin ile yüklü makrofajlar saptanması tanı koydurucudur. Bu tip olguları izlerken, pulmoner emboli, ARDS ve akciğer ödemi gibi patolojiler ayırıcı tanıda düşünülmelidir.Tablo 1.
İmmunsüpresif Hastada Pulmoner İnfiltrasyon Nedenleriİnfeksiyöz Nedenler
Bakteriyel S.aureus
Gram (-) bakteriler
Legionella spp.
Nocardia spp.
Viral
Cytomegalovirus
Herpes Simplex Virus
Adenovirus
Varicella Zoster Virus
Fungal P. carinii
C. neoformans
Aspergillus spp.
Mucorales
Candida spp.
Mikobakteriyel
M. tuberculosis
Paraziter
S. stercoralis
- gondii
İnfeksiyon Dışı Nedenler
Malignite
Altta yatan malignitenin yayılımı
Transplantasyon ya da altta yatan hastalığın tedavisi sonucu bağışıklık baskılanmasına sekonder gelişenler
Lösemi
Lenfoma
Kaposi sarkomu
Solid organ maligniteleri
Altta yatan neoplaz
i dışı hastalıkların ya da tedavilerinin oluşturduğu patolojilerİlaç / Radyasyon toksisitesi
Atelektazi
Kollajen vasküler hastalıklar
Lenfositik interstisyel pnömoni
BOOP
Akut akciğer hasarı, ARDS
Folliküler broşiolit
Pulmoner fibrozis
Non-spesifik interstisyel pnömoni
Üremik akciğer
Bağışıklık sistemi baskılanması ile ilişkisi olmayan yeni patolojiler
Kardiyak pulmoner ödem
Pulmoner emboli, infarkt
Lökoaglütinasyon reaksiyonu
Pulmoner hemoraji
Aspirasyon pnömonisi
Metastatik kalsifikasyonlar
Tablo 2.
Konak Savunma Defektlerine Göre Pulmoner İnfeksiyon Etkenlerinin Sınıflandırılması
Konak savunma defekti İnfeksiyon etkeni Oral ve trakeobronşiyal ülserasyon ve/veya obstrüksiyon Oral flora bakterileri Enterik Gram (-) bakteriler
Nötropeni Oral flora bakterileri Enterik Gram (-) bakteriler P.aeruginosa
Koagülaz (-) stafilokoklar
S. aureus
Streptokoklar
Enterokoklar
Candida
Aspergillus
Hipo-gammaglobülinemi S. pneumoniae H. influenzae tip B
Hücresel immun yetmezlik M. tuberculosis Atipik mikobakteriler Funguslar
CMV, VZV, HSV
P.carinii
T gondii
S.stercoralis
Kompleman eksikliği H.influenzae tip B S. pneumoniae
Tablo 3.
İmmunsüpresif Hastalarda Pulmoner İnfeksiyon Etkenlerinin İnfeksiyonun Seyrine Göre Sınıflandırılması
Ani başlangıç / hızlı seyir Subakut seyir Sinsi ve yavaş seyir P. carinii CMV Nocardia Bakteriler Aspergillus C. neoformans (Gram - çomaklar, Legionella S.aureus Mucorales M. tuberculosis CMV C. neoformans
ŞEKİL 1. Solid Organ Transplantasyonu Sonrası İnfeksiyonların En Sık Görülme Zamanları
ŞEKİL 2. Kemik İliği Transplantasyonu Sonrası İnfeksiyonların Görülme Zamanları
KLİNİK YAKLAŞIM
Bağışıklık sistemi baskılanmasının türüne göre etkenler farklı olduğundan, klinik yaklaşım kolaylığı açısından hastalar üç ana grupta değerlendirilmektedir:
Nötropenik olgular (nötrofil sayısı < 500 / mm 3)Nö tropenik olmayan olgular (Bu gruba kemik iliği ve solid organ transplantasyonu uygulananlar, steroid ya da immünosüpresif sağaltım alanlar, vb. girmektedir. Bu gruptaki olgularda nötropeni gelişmesi halinde, 1. Grupta değerlendirilmelidirler.)HIV (+) olgular
Nötropenik Olgular
Nötropeni ve infeksiyon ilişkisi 30 yıldan beri iyi bilinmektedir (23). Nötropeni, nötrofil sayısının 500 / mm3’ün (0.5 x 109 / L); derin nötropeni ise 100 / mm3’ün (1.0 x 109 / L) altında olması olarak tanımlanır. Buna ek olarak nötrofil sayısı 500-1000 arasında olan, ancak bu sayının süratle 500ün altına düşmesi beklenen olgular da nötropenik olarak değerlendirilir. Bu grupta etken ve prognozun belirlenmesinde nötropeni süresi ve derinliği önem taşır. Nötrofil sayısı 100/mm3 ün altında olan ve 10 günden uzun süren ya da sürmesi beklenen olgular yüksek risk grubu olarak değerlendirilir. Febril nötropeni, ateşin bir kere 38.3 ° C’nin üzerine çıkması ya da bir saat süreyle 38 ° C’ ya da üzerinde ateş olması olarak tanımlanır (24). Febril nötropenik atağın infeksiyona bağlı olma olasılığı % 60, akciğer tutuluşu ise % 20 düzeyindedir (25), ancak, otopsi çalışmalarında bu oranın %90 a kadar çıktığı bildirilmiştir.
Nötropenide yangısal yanıt olmaması nedeniyle, pnömoni olmasına karşın, fizik bakı ve akciğer grafisi tümüyle normal olabilir. Bu olgularda, pürülan balgam %8e varan düşük oranlarda bildirilmiştir. Hastanın nötropeniden çıkmasıyla, klinik bulguların düzelmesiyle tezat oluşturacak şekilde, radyografik bulguların ve rallerin ortaya çıktığı gözlenebilir ve infeksiyon progresyonu olarak nitelenmemelidir.
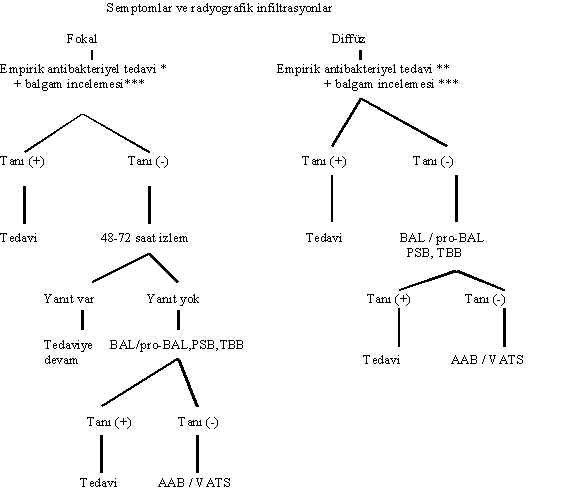
Bu olgularda radyografik bulguların fokal ya da diffüz / interstisyel olması klinik yaklaşımı belirleyecektir (Şekil 3) (26-28).
Non-nötropenik Olgular
Bu grup çok geniş bir hastalık spektrumunu içermektedir. Olgular çok değişik alt gruplara (solid organ / nötropeniden çıkmış kemik iliği transplantasyonu, uzun süreli steroid / immünosüpresif sağaltım, vb) ayrılabilir ve her alt gruptaki olgularda öncelikli olası etkenler ve sık görülme zamanları değişebilir (Tablo 2, Şekil 1, Şekil 2, Şekil 4) (29-33).
Hematopoetik kök hücre transplantasyonu sonrası, kemik iliği yapılanması tamamlanmış ve böylece nötrofil saytısı normale dönmüş hastalarda (alıcılarda) geç dönemde daha çok pnömokokların sorumlu olduğu bakteriyel pnömoniler görülmektedir. Allogeneik transplant alıcılarında, profilaktik ve “preemptive” tedavinin yaygın kullanımına karşın CMV hala önemli bi
r sorundur ve transplantasyon sonrası 1-4 aylarda görülmektedir. CMV seropozitif KİT alıcılarının %70inde CMV infeksiyonu saptanmaktadır (5). Bu grup hastalarda etkin profilaksi sayesinde P. carinii pnömonisi çok azalmıştır (5). KİT sonrası tüberküloz riski genel topluma göre daha yüksek olmakla birlikte, çok büyük bir sorun olarak kabul edilmemektedir (34). Ülkemizde 200 olguluk bir seride iki hastada tüberküloz geliştiği görülmüştür. Her 2 olguda da kronik GVHD söz konusudur. Solid organ transplant alıcılarında hastanede izlenilen dönemde, hastane kökenli pnömoniler, daha seyrek olarak da, Nocardia, Legionella gibi etkenler saptanabilmektedir. Bu olgularda, toplumdan kazanılmış pnömoni etkeni olarak en sık H. Influenzae ile karşılaşılmaktadır. Bu grupta viral etkenler içinde en önemlisi yine CMV’dir. CMV infeksiyonu insidensi renal transplant alıcıları için % 75 olarak bildirilmiştir (35). Ülkemiz için bu oran % 31-81 olarak belirtilmiştir. Renal transplant alıcılarında tüberküloz insidensi ülkemizde % 2-4 düzeyinde bildirilmiştir (12,13,16).Gerek nötropenik gerekse non-nötropenik olgularda radyolojik paterne göre etkenler değişmektedir. Radyolojik bulgulara göre daha ön planda düşünülen olası etkenler ve non-infeksiyöz süreçler Tablo 4, 5 ve 6 da gösterilmiştir. Radyolojik bulgulara dayanan yaklaşım, ayırıcı tanı spektrumunu daraltmak amacıyla kullanılabilir, ancak, bu olgularda radyolojik bulguların çok değişkenlik gösterebildiği, yanıltıcı olabileceğı ve mikrobiyolojik tanının temel olduğu unutulmamalıdı
r.Tablo 4.
Radyolojik Yaygınlığa Göre Olası İnfeksiyon Etkenleri
Radyolojik patern Nötropenik Olgular
Non-nötropenik Olgular
Sık Ender TKP HKP Fokal Enterik Gram (-) Basiller L. pneumophila S.pneumoniae P.aeruginosa P. aeruginosa M. pneumoniae M. pneumoniae Enterik Gram (-) basiller Aspergillus spp. P. carinii L.pneumophila S.aureus Candida spp. Nocardia spp C.pneumoniae L.pneumophila M.tuberculosis M.tuberculosis C.neoformans Enterik Gram (-) basiller Mucorales Nocardis spp. Diffüz/interstisiyel L. pneumophila L.pneumophila P. carinii P.carinii Virüsler (ör. CMV) Influenza A C.pneumoniae M.pneumoniae M.tuberculosis S.stercoralis
Tablo 5.
Radyolojik Bulguların Özelliklerine Göre Olası İnfeksiyon Etkenleri
Konsolidsyon Nodüler +/- kavite İnterstisiyel Miliyer Gram (+) ve Gram (-) Bakteriler M.tuberculosis P. carinii M.tuberculosis Legionella Nocardia CMV Coccidioides Aspergillus Aspergillus HSV, VZV Histoplasma Mucorales Mucorales Adenovirus Toxoplasma Gram (-) basiller RSV HSV, VZV S. aureus Anaerob bakteriler Tablo 6. Non-infeksiyöz süreçlerde radyolojik bulgular
Diffüz Nodüler veya kaviteli Fokal Akciğer ödemi Malignite NIP (Nonspesifik interstisyel pnömoni NIP Septik emboli İlaca bağlı lezyonlar Lenfanjitis karsinomatoza Alveoler hemoraji Lösemik tutulum
HIV (+) Olgular
Ülkemizde şimdiye dek izlenen olgularda elde edilen deneyim uluslararası deneyime paraleldir ve bu olgulara yaklaşımda yayınlanmış öneriler aynen benimsenmiştir.(Şekil 5)
Bu grupta infeksiyöz etkenler, hastalığın evresine (CD4 sayısına) göre değişmektedir (Tablo 7). Bakteriyel patojenler arasında en sık saptanan
S. pneumoniae’ dır (% 60). Bakteriyemik olgularda bu oranın % 89 olduğu bildirilmiştir. H. influenzae ve P. aeruginosa diğer sık karşılaşılan etkenlerdir. P. carinii, HIV infeksiyonu olmayan olgularda daha akut seyirli klinik tablolara yol açarken, HIV (+) olgularda kronik gidiş görülebilir. Benzer şekilde, diffüz bilateral infiltrasyonlar tipik radyografik görünüm olmakla birlikte, özellikle pentamidin profilaksisi uygulanan olgularda değişik atipik radyografik bulguların da olabileceği bilinmektedir (Tablo 8). Mortalite oranının % 5-43 arasında olduğu bildirilmektedir (14).Tablo 7.
HIV (+) olgularda CD4 (+) hücre sayısı ve daha sık karşılaşılan infeksiyöz hastalıklar ve infeksiyon-dışı sorunlar
CD4 Say
ısıİnfeksiyon Etkeni
CD4 < 100
MAC, CMV, Candida, Cryptocococcus
CD4 100-199
PCP, Kaposi, bakteriyel sepsis, M. tuberculosis
CD4 200-299
M. tuberculosis, tekrarlayan pnömoni
CD4 300-399
Pnömoni, M. tuberculosis, kardiyomyopati
CD4 > 400
Sinüzit, otit, farenjit, bronşit,
M. tuberculosisTablo 8. P. carinii
pnömonisi radyografik bulguları
Tipik
Diffüz bilateral interstisyel ya da alveoler infiltrasyonlar Atipik
Normal Üst lob infiltrasyonları Parankimal kistler ya da anfizem blebleri Pnömotoraks Plevral efüzyon Fokal infiltrasyonlar Nodüler infiltrasyonlar Kitle lezyonları Kavitasyon gösteren kitle, nodül, ya da fokal konsolidasyon alanı Subsegmental atelektazi Hiler ve mediastinal lenfadenopati Bronşektazi
TANI
BBH de pnömoni tanısında anamnez, fizik bakı bulguları ve radyolojik incelemelerin yanısıra, solunum yolları örneklerinin mikrobiyolojik ve patolojik açıdan incelenmesi önem taşımaktadır. Mikrobiyolojik tanımlamada, direkt preparatların incelenmesi, bakteriyel, mikobakteriyel, viral ve fungal kültürler ve serolojik yöntemler kullanılabilir. Bazı infeksiyonlarda
(CMV, Legionella, P. carinii) örneklerden doğrudan antijen tanımlanması tanı için anlamlıdır. CMV hastalığı tanısı, CMV antijenemisinin gösterilmesi ile konur. Benzer şekilde, Legionella infeksiyonlarında, idrarda Legionella antijeninin gösterilmesi tanıda önem taşımaktadır. Ayrıca, pnömoniler sıklıkla bakteriyemi ya da fungemi ile birlikte olduğu için, bu olgulardan hemokültür gönderilmesi de gereklidir. Bunların yanısıra, özellikle primer viral infeksiyonlarda etkene yönelik antikorların serolojik yöntemlerle gösterilmesi tanıya yardımcı olmaktadır. Patolojik olarak, tüm solunum yolu örneklerinde rutin hematoksilen-eosin boyası yanısıra, Ziehl-Nielsen, Gomori methenamine silver, toluidine blue, Giemsa, PAS boyaları ve gerektiğinde, direkt immun floresan incelemeleri yapılmalıdır.Önceden antibiyotik başlanmış olması, orofaringeal kontaminasyon (balgam, lavaj ve BAL), aspirasyon kanalı kontaminasyonu (lavaj, BAL), invaziv işlem tekniğinin yanlış uygulanması ve klinisyen – mikrobiyolog - patolog iletişimsizliği tanısal başarıyı etkilerken; korumalı fırça ve pro-BAL’da göreceli yüksek maliyet söz konusudur.
Balgam incelemesi
Balgam en değerli örnektir. Nitelikli balgam örneği 100x büyütmede, her sahada 25 ten çok nötrofil, 10 dan az epitel hücresi içermelidir. Ancak, nötropenik olgularda ve Legionella infeksiyonlarında balgamda yeterli nötrofil görülemeyeceği unutulmamalıdır. Balgam örneği en geç iki saat içinde mikrobiyoloji ve patoloji laboratuvarlarında işleme konulmalıdır. Gram, Giemsa, Ziehl-Nielsen, Gomori methenamine silver, Toluidine blue, hematoxylene-eosin gibi boyama yöntemleri ve direkt ve indirekt floresan antikor testleri uygulanmalıdır (36,37). Sitopatolojik değişikliklerin değerlendirildiği viral infeksiyonlar ve kontaminasyon nedeniyle invaziv hastalığın gösterilmesinin gerekli olabileceği fungal infeksiyonların tanısında balgam genellikle yetersiz kalmaktadır ve bu gibi durumlarda daha ileri incelemeler gerekebilir. Bu hasta grubunda ayırıcı tanının çok geniş olması nedeniyle patoloji ve mikrobiyoloji çalışanları ayrıntılı olarak bilgilendirilmelidir.
Balgam sonuçları kolonizasyon / infeksiyon ayırımı açısından dikkatle değerlendirilmelidir. Olanak varsa, balgamın kantitatif bakteriyolojik kültürü yapılmalı, anlamlı sonuçlar için eşik sınır olarak 106 cfu/ml kabul edilmelidir. Balgam çıkaramayan olgularda, %3 NaCl solüsyonu küçük rezervuarlı nebülizatör kullanılarak, fizyoterapi tekniklerinden yararlanılarak solunum sekresyonları elde edilebilir.
Merkez deneyimine ve olanaklarına göre, tanısal başarı değişkenlik gösterir. Örneğin,
P. carinii pnömonisinde hipertonik salin inhalasyonu ile elde edilen balgam örneklerinde, % 15-100 arasında değişen başarı oranları bildirilmiştir (38).Bronkoskopik işlemler
Bu işlemler invaziv işlemlerdir ve hasta ve/veya yakınlarını öncelikle bilgilendirilmesi ve onaylarının alınması gereklidir. Tüm bronkoskopik işlemler, yakın monitorizasyonla yapılmalıdır.
BAL:
Olgu oda havası solurken PaO2 düzeyi ek oksijen uygulanmasına karşın 60 mmHg dan düşük olan ya da PaO2 / FiO2 oranı 200 den düşük olan, trombosit sayısı 20000 (mm3’ ün altında olan, protrombin zamanı (INR), kanama zamanı değerlerinde %50 den daha yüksek düzeyde artış olan olgularda uygulanmaması önerilir. Trombositopenik olgularda, aynı gün yapılacak trombosit süspansiyonu infüzyonlarıyla trombosit düzeyi güvenli sınırlara getirilebilir. İşlem 100 ml NaCl solüsyonu ile yapılmalı ve sıvı en az % 40 oranında geri alınmalıdır.
Bakteriyolojik incelemelerde kantitatif kültür yapılmalı, anlamlılık için eşik değer
>104 cfu/ml kabul edilmelidir (yalnızca bronkoskopik ya da endotrakeal aspirasyon materyeli alındığında bu değer, 106 cfu/ml dir). Diffüz lezyonlarda işlem orta lobdan, lokalize olanlarda, görüntüleme yöntemleriyle en yoğun tutuluş saptanan bölgeden yapılmalıdır.BAL örneklerinin işlenmesine ve kantitatif kültür yöntemine ilişkin öneriler, Ek 1 ve Ek 2 de sunulmuştur.
Pro-BAL tek kullanımlık kateter gerektirmesi nedeniyle görece pahalı bir yöntemdir, ancak bronkoskopun daha proksimalde tutulabilmesi nedeniyle hasta daha rahat edebilmekte ve kanama ve kontaminasyon oranı daha düşük olmaktadır. Bu işlemle alınan materyelin kantitatif kültüründe eşik değer
> 103 cfu/ml olarak kabul edilmektedir (39,40).PSB (korumalı fırçalama)
Tek kullanımlık kateter gerektirmesi nedeniyle görece pahalı bir yöntemdir. Öncelikle bakteriyel bir etken düşünülen ve trombosit sayısı 50000/mm3 ün üzerinde olan olgularda yapılmalıdır. Bronkoskop materyel alınacak segmentten daha proksimalde tutularak kontaminasyon
önlenmelidir. Fırça önce steril koşullarda, steril bir lama yayılmalı (ardından Gram boyalı preparat hazırlanmalı) ve hemen steril bir makasla 1 cc Ringer laktat solüsyonu içeren tübün içine kesilmeli ve mikrobiyoloji laboratuvarına hızla transportu sağlanmalıdır. Kantitatif kültürde eşik değer >103 cfu/ml olarak kabul edilmelidir (40,41).TBB (Transbronşiyal biyopsi)
Bronkoskopik yöntemler içinde en invaziv ve en yüksek morbiditeye sahip olan yöntemdir. Her olguda yarar ve zarar hesabı yapılarak uygulanmalıdır. Diffüz lezyonlarda alt lobdan, lokalize infiltrasyonlarda ilgili bölgeden 4-6 biyopsi örneği alınmalıdır. Yüksek komplikasyon oranı nedeniyle orta lobdan kaçınılması önerilmektedir. Mümkünse floroskopi altında yapılmalıdır. Hasta seçiminde BAL için
belirtilen önkoşullara ek olarak trombosit sayısının 50000 /mm3 ün üzerinde olmasına dikkat edilmelidir (41,42).Ayırıcı tanıda ön planda bakteriler düşünülüyorsa pro-BAL, PSB; PCP düşünülüyorsa balgam, BAL; mikobakteriler düşünülüyorsa balgam, BAL; CMV,
HSV, Aspergillus, Candida, infeksiyon dışı nedenler düşünülüyorsa TBB tercih edilmelidir.Transtorasik ince iğne aspirasyonu
Ayırıcı tanıda tümör düşünülen olgularda uygulanabilir. Son yıllarda 25 no’lu çok ince Chiba iğnesiyle 2cc serum fizyolojik verilip aspirasyonunun bakteriyel infeksiyonlarda yararlı olabileceğine ilişkin yayınlar vardır (41).
Açık akciğer biyopsisi / VATS
Minimal invaziv olarak kabul edilen her iki yöntem de tanısal yaklaşımın son basamağını oluşturur. İşlem öncesinde klinisyen, mikrobiyolog ve patologun katıldığı hastabaşı toplantısında tanı ve ayırıcı tanının tartışılması tanısal verimliliği arttıracaktır. Her iki yöntemde de tanısal verimlilik % 90 ın üzerindedir. Minör komplikasyon oranı % 2-2
0 düzeyinde, mortalite %1 in altındadır. INR / PZ / kanama zamanı beklenenin % 150sinden fazla olmamalı, trombosit sayısı 100000/mm3 ün üzerinde olmalıdır. Yüksek riskli olgularda daha güvenli bir yöntem olması nedeniyle TBB’ye tercih edilmelidir.AAB kas
koruyucu mini torakotomi yöntemiyle 6-10 cm’lik insizyonla yapılır. Viseral plevradan uzaklığı 3 cm’den daha derinde nodülü olan ya da tek akciğer ventilasyonu uygulanamayacak olgularda AAB VATS’a tercih edilmelidir. Diğer olgularda, morbiditesinin daha düşük olması nedeniyle VATS öncelikli olarak düşünülebilir.Her iki yöntemle de alınan materyel steril kaba alınmalı ve mikrobiyoloji ve patoloji laboratuvarlarına hızla transportu sağlanmalıdır. Daha önceden belirtilen boyama yöntemleri burada da uygulanmalıdır (36,37,43-50).
BBH’de alt gruplara göre tanı ve tedavi yaklaşımları Şekil 3,4, ve 5’de özetlenmiştir. Fokal infiltrasyonlarda, nötropenik olgularda empirik tedavide antipsödomonal ajanlar öncelikle yer alırken nötropenik olmayan BBH’lerde ve HIV (+)’lerde pnömoninin TKP ya da HKP oluşuna göre tedavi önerilmektedir. Yine nötropenik fokal infiltrasyonlu olgularda, diğer gruplardan farklı olarak tedaviye yanıt vermeyenlerde empirik glikopeptid antibiyotikler ve antifungal ajanlar gündeme gelebilmekted
ir.
Şekil 3 : Nötropenik olgularda tanı ve tedavi yaklaşımı
* Nötropeniden çıkıldığı dönemde ortaya çıkan infiltrasyonlar yangısal reaksiyonun belirginleşmesi
(görünebilir hale gelmesi) nedeniyle olabileceği için, bu olgular ö
ncelikle izlenmelidir.Balgam dışında, plevra sıvısı ve kan gibi diğer örneklerin de mikrobiyolojik incelemesi yapılmalıdır.
Balgamda Pseudomonas
dışı bir bakteri soyutlansa bile, başlanan antipseudomonal antibiyotikkesilmemeli, gerek varsa, yeni ilaç eklenmelidir.
** İzlemde temel olarak ateş yanıtı dikkate alınmalıdır.
*** Hastanın klinik durumuna göre bronkoskopi amphotericin B sağaltımının başlanmasıyla eş
zamanlı yapılabilir ya da amphotericin B sağaltımının 48-72 saatteki yanıtı
beklenebilir
Febril nötropenisi olan olgu şoktaysa, kalıcı kateteri varsa, kinolon profilaksisi almaktaysa, ciddi mukozit bulguları varsa, bu aşamada tedaviye glikopeptid eklenmelidir.
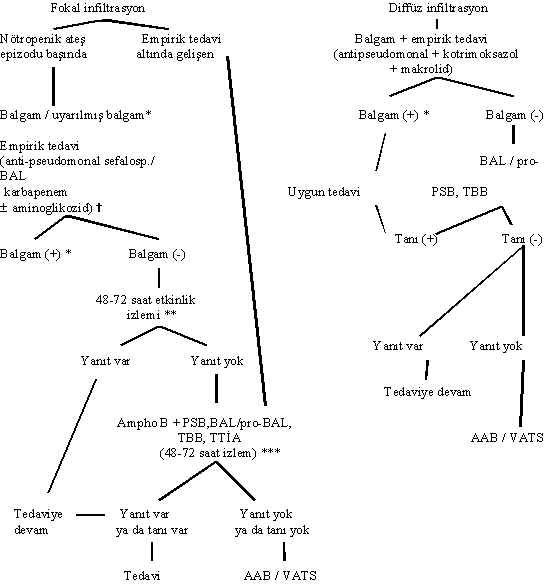
Şekil 4: Nötropenik olmayan BBH’de tanı ve tedavi yaklaşımı
* Hücresel bağışıklığı bozuk (ör. st
eroid alan) olgularda makrolid önerilebilir. Legionella infeksiyonu kanıtlandığı takdirde rifampisin eklenebilir. Hümoral bağışıklığı bozuk (ör. multipl myelom, KLL) olgularda, infeksiyon toplum kökenli ise beta-laktam + beta-laktamaz inhibitörü ya da 2. kuşak sefalosporin; hastane kökenli ise 3. kuşak antipsödomonal sefalosporin ya da 4. kuşak sefalosporin + aminoglikozid ya da kinolon verilebilir (Bu konuda daha ayrıntılı bilgi için hastane kökenli pnömoniler tanı ve tedavi rehberlerine bakılabilir).** Empirik tedavi için makrolid + kotrimoksazol kombinasyonu önerilebilir.
*** Balgam dışında, plevra sıvısı ve kan gibi diğer örneklerin de mikrobiyolojik incelemesi yapılmalıdır.
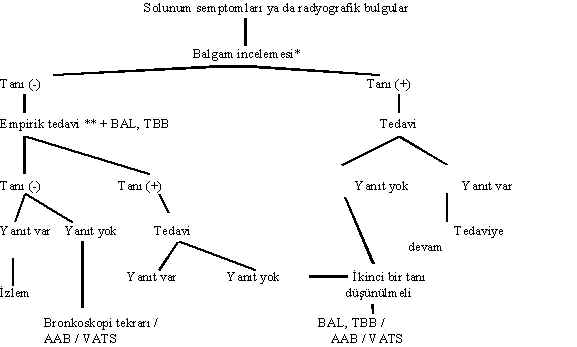
Şekil 5 : HIV (+) olgularda tanı ve tedavi yaklaşımı
* Balgam dışında, plevra sıvısı ve kan gibi diğer örneklerin de mikrobiyolojik incelemesi yapılmalıdır.
** CD4 hücre sayısı 200ün altına düşmüş olgularda, her türlü radyografik bulguların varlığında empirik kotrimoksazol (trimetoprim 20 mg/kg) uygulanma endikasyonu vardır.
CD4 hücre sayısının 200ün üzerinde olduğu olgularda, hastane ya da toplum kökenli oluşuna göre antibiyotik seçimi yapılır (Bu konuda daha ayrıntılı bilgi için hastane kökenli pnömoniler tanı ve tedavi rehberlerine bakılabilir).
TEDAVİ
BBH’de infeksiyon tümüyle ekarte edilene dek, immün süpresif tedavi yoğunluğu olabildiğince azaltılmalı, mümkünse kesilmelidir. Tedavi süresi bakteriyel infeksiyonlarda 14-21 gün olmalıdır.
P. carinii pnömonisinde 20 mg/kg/gün trimetoprime eşdeğer dozda kotrimoksazol 21 gün (bir fort tablette 160 mg trimetoprim vardır) süreyle uygulanır. PaO2 düzeyi 70 mmHg’nın altında olan ya da P(A-a)O2 gradientinin 35 mmHg’dan yüksek olan P. carinii pnömonili olgularda, 5 gün 80 mg, 5 gün 40 mg, ve tedavi sonlanana dek 20 mg/gün prednizolon tedaviye eklenmelidir (14).CMV pnömonisinde gansiklovir 10 mg/kg/gün iki eşit doza bölünerek birer saatlik infüzyonla 14-21 gün süreyle uygulanır. Gansiklovirin nötropeni yapıcı etkisi göz önünde tutulmalıdır. Tedavide, bugün standart yaklaşım, gansiklovire ek olarak, etkinliği kanıtlanmamış olmakla birlikte, immun globülin uygulanmasıdır. Bağışıklığın yoğun olarak
baskılandığı (anti-timosit globülin, OKT3 vb. uygulananlar) ya da virus ekskresyonu (BAL’da virus antijeni saptanması) ya da antijenemi saptanan olgularda, “preemptive” (klinik hastalık öncesi - erken) tedavi, yukarıda belirtilen doz ve sürede uygulanır.Aspergilloziste, amfoterisin B 1-1.5 mg/kg/gün dozda (empirik sağaltımda 1 mg/kg/gün, kanıtlanmış invaziv aspergilloziste 1.5 mg/kg/gün) klinik ve radyolojik olarak tam düzelme olana dek kullanılmalıdır. Amfoterisin B, %5 dekstroz içinde verilmesine ve ol
guların serum sodyum düzeylerinin normal sınırlarda olmasına dikkat edilmelidir. Renal toksisite saptanan olgularda lipozomal amfoterisin B preparatları kullanılabilir.Kemoterapi uygulanması sırasında nötropeni gelişen olgularda, izleyen kemoterapilerde koruyucu amaçlı olarak bu faktörlerin kullanılması, kemoterapi yoğunluğunun azaltılmaması amacına yönelik olarak önerilmektedir. Solid organ tümörlerindeki nötropeni dönemlerinde bu faktörlerin uygulanmasının nötropeni süre ve derinliğini azaltmasına karşın, mortalitede anlamlı düzelme sağlamadığı bildirilmektedir. Bu nedenle, maliyetleri göz önüne alınarak, her olguda bireysel maliyet-yarar değerlendirilmesi yapılmalıdır (51,52).
Tüberkülozda, ülkemizdeki yüksek ilaç direnci göz önüne alınarak tedavi en az dört majör ilaçla uygulanmalı; İzoniazid (H), rifampisin (R), pirazinamid (Z) + etambutol (E)/ streptomisin (S) ve bu tedavi en az iki ay sürdürülmelidir. Kültür negatifleşmesi saptandığında HR tedavisine geçilerek tedavi toplam 9 aya tamamlanmalıdır (5
3,54).
KORUNMA
K
orunmanın temelini, el yıkama başta olmak üzere, genel infeksiyon önlemleri oluşturur. Öneriler Tablo 9 da özetlenmiştir (55).Erişkin BBH’de canlı aşı yapılması kontrendikedir. Bağışıklık sistemi baskılanmamış olgulara oranla koruyuculuk oranları daha düşük olmakla birlikte, influenza ve pnömokok aşıları yapılmalıdır (56,57). Antikor yanıtının düşük olması nedeniyle, pnömokok aşısı bu olgularda 6 yıl sonra yinelenebilir. Solid organ transplant adayı hastalarda aşıların transplantasyo
ndan / immünosüpresif sağaltım uygulanmasından önce yapılması tercih edilmelidir. Kemik iliği transplant alıcılarında, aşılanma post-transplant 6-12. ayda önerilmektedir.P. carinii
profilaksisi CD4+ lenfosit sayısı 200/mm3’ün altında olan ya da CD4 / total lenfosit oranı 1:5 in altında olan ya da CD4+ hücre sayısına bakılmaksızın açıklanamayan ateş ya da oral kandidiyazisi olan HIV (+) olgularda primer korunma amacıyla, PCP geçirmiş olgularda ise sekonder korunma amacıyla TM 5 mg/kg/gün’e eşdeğer dozda kotrimoksazol yaşam boyu verilmelidir. Transplant alıcılarında aynı doz haftada iki kez uygulanması yeterlidir. Profilaksi kemik iliği transplantasyonunda, engraftment’dan sonra 100-180. güne dek sürdürülmelidir (58). Ancak, özellikle kronik GVHD’de, steroid kullanan olgularda profilaksinin bir yıla dek devam etmesi ve yaygın kronik GVHD’lilerde, bir yıldan sonra da sürdürülmesi önerilmektedir (14,59). Renal transplant alıcılarında, bu uygulama 12 ay sürdürülmektedir. Kotrimoksazol intoleransı olan olgularda pentamidin ayda bir kez 300 mg dozda nebülizasyonla uygulanabilir (60).Allogeneik transplant alıcılarında CMV profilaksisi için asiklovir (500 mg/m
2, 8 saatte bir, 4-6 ay) önerilmektedir. Alıcı seronegatif - verici seropozitif olan durumlarda gansiklovir 2.5 mg/kg/gün dozda 1-3 ay süreyle verilmelidir (61-63). Seronegatif alıcılarda, seronegatif kan ürünleri ya da lökosit filtreleriyle lökositlerin giderildiği kan ürünleri verilmesi önerilir.KİT alıcılarında, nötropenik dönemde flukonazol (400 mg/gün) ile antifungal profilaksi uygulanabileceği belirtilmektedir
(5,14,64-66). Bu profilaksi Candida infeksiyonlarına yönelik olarak uygulanmaktadır.INH kemoprofilaksisinin, HIV (+) ya da diğer immün süpresyon gruplarında yer alan tüberkülin reaksiyonu 5 mm den fazla olan olgularda 12 ay süreyle 300 mg/gün dozda 50 mg piridoksin ile kombine olarak uygulanması birçok uluslarası uzlaşı raporunda vurgulanmaktadır (53) ve bu yaklaşım ülkemiz için de önerilmiştir (67). 35 yaşın üzerindeki olgu
larda hepatotoksisite riskinin % 2-3 düzeyinde olması nedeniyle yakından izlem gereklidir. Transplant alıcılarında, hepatit B ve C infeksiyon prevalansının yüksek olması, siklosporin serum düzeyleriyle etkileşim olasılığı nedeniyle, bireysel olarak risk-yarar değerlendirmesi yapılarak endikasyon sınırlandırılabilir.Ülkemizde infeksiyon havuzunun büyük olması ve kemoprofilaksi uygulanmayan transplant hastalarında % 3 oranında tüberküloz gelişmesi (genel popülasyonun yaklaşık 10 katı) bu konunun ülkemiz için önemini vurgular niteliktedir (12,13,51). Diğer yandan, ülkemizdeki % 10 düzeyindeki INH primer direnci nedeniyle optimal kemoprofilaksi rejiminin ne olduğunun belirlenmesi araştırmaya değer bulunmuştur. Ev içinde çok ilaca dirençli bir olgu ile temas söz konusu ise, indeks olgunun direnç paterni dikkate alınarak profilaktik tedavi düzenlenmelidir.Tablo 9.
BBH’de solunum yolları infeksiyonlarının önlenmesi
İnfeksiyon
Korunma yaklaşımları
Pnömokoksik pnömoni
Pnömokok aşısı, oral ya da depo penisilin profilaksisi,
immün globülin ile pasif korumaİnfluenza
İnfluenza aşısı (her yıl), amantadin veya rimantadin profilaksisi (yalnızca influenza A virusu için)
Hemophilus influenzae
H. Influenzae
tip B aşısıTüberküloz
Yeni olguların saptanması ve tedavi edilmesi
, infeksiyon kontrol önlemleri, INH ile profilaksiMAC hastalığı
Klaritromisin ya da azitromisin profilaksisi
P. carinii pnömonisi
TMP-SMX (PO) ya da pentamidin (aerosol) profilaksisi
CMV pnömonisi
CMV serone
gatif organ alıcıları için CMV seronegatif organların ve kan ürünlerinin kullanılması, CMV hiperimmun globülin ile pasif koruma, antiviral ajanlar (asiklovir, gansiklovir) ile profilaksiLegionella pnömonisi
Kaynağın bulunması, su kaynakları ile ilgili
infeksiyon kontrol yöntemlerinin uygulanması (suların klorlanması, sıcak su ısısının 50 C’ninüzerinde tutulması vb)
Aspergillosis
Sporların hava yolu ile taşınmasını azaltmak için HEPA filtrelerinin kullanılması, spor taşıyabilecek bitkilerin hastane ortamında bulundurulmaması
Candida
hastalığıAntifungal ajanlar ile koruma
Cryptococcosis
Güvercinler ve dışikılarından uzak durulması,
antifungal ajanlar ile profilaksi
KAYNAKLAR
- Rosenow EC III, Wilson WR, Cockerill FR
III. Pulmonary disease in the immunocomprmised host. Mayo Clin Proc 1985; 60: 473-87- Akova M.
Nötropenik ateş ve akciğer. Uçan ES (Ed) Pnömoniler: Bir Devin Uyanışı, Saray Tıp Kitabevi, İzmir, 1996, 147-59- Fanta CH, Pennington JE.
Pneumonia in the immunocompromised host. In: Pennington JE (Ed) Respiratory Infections: Diagnosis and Management, Raven Press, New York, 1994, 275-94- Uçan ES.
İmmunsüprese hastalarda enfeksiyon dışı akciğer patolojileri. Uçan ES (Ed) Pnömoniler: Bir Devin Uyanışı, Saray Tıp Kitabevi, İzmir, 1996, 207-24- Soubani AO, Miller KB, Hassoun PM.
Pulmonary complications of bone marrow transplantation. Chest 1996; 109: 1066-77- Arseven O.
Bağışıklığı baskılanmış hastalarda pnömoni. Klimik Dergisi 1995; 8: 3-9- Hadley S, Karchmer AW.
Fungal infections in solid organ transplant recipients. Infect Dis Clin North Am 1995; 4: 1045-1073- Houston SH, Sinnott JT.
Management of the transplant recipient with pulmonary infection. Infec Dis Clin North Am 1995; 9: 965-1003- Ettinger NA, Trulock EP.
Pulmonary considerations of organ transplantation. Part II. Am Rev Respir Dis 1991; 144: 213-223- Harrington RD.
Legionellosis in a bone marrow transplant center. Bone Marrow Transplantation 1996; 118: 361-368- Kürşat S, Ok E, Zeytinoğlu A, Tokat Y, Saydam G, Cirit M, Akçiçek F.
Nocardiosis in renal transplant patiens. Nephron 1997; 75: 370-371- Karaca N, Aytemur ZA, Sayıner A, Ok E, Çelik A, Tokat Y, Hoşcoşkun C.
22. Türk Tüberküloz Kongresi Kitabı, Marmaris, 1997 (baskıda)- Tokat Y, Kılıç M, Kürşat S, Ok E, Sayıner A, Tanıl V, Başcı A.
Tuberculosis after renal transplantation. Transplantation Proc 1996; 28: 2353-2354- Santamauro JT, Stover DE.
Pneumocystis carinii pneumonia. Med Clin North Am 1997; 81: 299-311- Zeytinoğlu A, Erensoy S, Çoker A, Bilgiç A, Günhan C.
Böbrek transplantasyonu alıcılarında sitomegalovirus enfeksiyonu. Mikrobiyol Bült 1994; 28: 160-165- Gülay Z, Gülay H, Erkan N, Sıfıl A, Kavukçu S, Erdamar İ.
Infections in kidney recipients: analysis of 48 consecutive transplantations performed at a center. Türkiye Organ Nakli Derneği IV. Bilimsel Kongresi Özet Kitapçığı, 5-7 Kasım 1997, Ankara, 80- Ettinger NA.
The role of bronchoscopy in organ transplant recipients. J Bronchol 1995; 2: 43-58,- Minamoto GY, Rosenberg AS.
Fungal infections in patients with AIDS. Med Clin North Am 1997; 81: 381-409- Yu VL, Muder RR, Poorsattar A.
Significance of isolation of Aspergillus from the respiratory tract in diagnosis of invasive pulmonary aspergillosis. Am J Med 1986; 81: 249-254- White DA.
Pulmonary infection in the immunocompromised patient. Semin Thorac Cardiovasc Surg 1995; 7: 78-87- Alper H.
İmmunsüpresif hastalarda akciğer patolojilerinin radyolojisi. Uçan ES (Ed) Pnömoniler: Bir Devin Uyanışı, Saray Tıp Kitabevi, İzmir, 1996, 243-58- Hruban RH.
Radiologic-pathologic correlation of the CT halo sign in invasive pulmonary aspergillosis. JCAT 1987; 11: 534-6- Bodey GP, Buckley M, Sathe YS, Freireich EJ.
Quantitative relationships between circulating leukocytes and infection in patients with acute leukemia. Ann Intern Med 1966; 64: 328-339- Hughes WT, Armstrong D, Bodey GP ve ark.
1997 guidelines for the use of antimicrobial agents in neutropenic patients with unexplained fever. Clin Infect Dis 1997; 25: 551-73- Giamarellou H.
Empiric therapy for infections in the febrile, neutropenic, compromised host. Med Clin North Am 1995; 79: 559-580- Arseven O.
Tanısal algoritm: Ne ? Ne zaman ? Uçan ES (Ed) Pnömoniler: Bir Devin Uyanışı, Saray Tıp Kitabevi, İzmir, 1996, 225-242- Shelhamer JH, Toews GB, Masur H, et al.
Respiratory disease in the immunosuppressed patient. Ann Intern Med 1992; 117: 415-31- Pizzo PA.
Management of fever in patients with cancer and treatment-induced neutropenia. New Eng J Med 1993; 328: 1323-32- Sayıner A.
Transplantasyon ve akciğer. Uçan ES (Ed) Pnömoniler: Bir Devin Uyanışı, Saray Tıp Kitabevi, İzmir, 1996, 179-205- Cohen J, Hopkin J, Kurtz J.
Infectious complications after renal transplantation. Morris PJ (Ed) Kidney Transplantation: Principles and Practice. WB Saunders Comp. Philadelphia, 1994: 364- Winston DJ.
Infections in bone marrow transplant recipients. Mandell GL, Bennett JE, Dolin R (Eds), Principles and Practice of Infectious Diseases, Churchill Livinstone, New York, 1994: 2717- Bowden RA, Meyers JD.
Infection complicating bone marrow transplantation. In: Rubin RH, Young LS (Eds), Clinical Approach to Infection in the Compromised Host, Plenum Press, New York, 1994: 601-28- Rubin RH.
Infection in the organ transplant recipient. In: Rubin RH, Young LS (Eds), Clinical Approach to Infection in the Compromised Host, Plenum Press, New York, 1994: 629-705- Martino R
. Tuberculosis in bone marrow transplant recipients: report of two cases and review of the literature. Bone Marrow Transplant 1996; 18: 809-812- Ettinger NA, Trulock EP.
Pulmonary considerations of organ transplantation. Part 1. Am Rev Respir Dis 1991; 143: 1386-1405- Kargı HA
. İmmunsüprese hastalarda akciğer komplikasyonlarının patolojik tanısı. Uçan ES (Ed) Pnömoniler: Bir Devin Uyanışı, Saray Tıp Kitabevi, İzmir, 1996, 287-302- Yüce A.
Pnömonilerde mikrobiyolojik tanı. Uçan ES (Ed) Pnömoniler: Bir Devin Uyanışı, Saray Tıp Kitabevi, İzmir, 1996, 267-86- Baselski VS, Wunderink RG.
Bronchoscopic diagnosis of pneumonia Clin Microbiol Rev 1994; 7: 533-558- Bjermer L, Rust M, Heurlin N, Rennards S, Klech H.
The clinical use of BAL in patients with pulmonary infections. Eur Respir Rev 1992; 2: 106-13- Broughton WA, Middleton RM, Kirkpatrick MB, Bass JB.
Bronchoscopic protected specimen brush and bronchoalveolar lavage in the diagnosis of bacterial pneumonia. Inf Dis Clin North Am 1991; 5: 437-52- Sayıner A.
Diagnostic techniques and algorithms in respiratory disease of immunosuppressed patients. Proceedings of the 1st Mediterranean Congress on Interventional Diagnosis for Thorax Diseases (Ed: G. Antypas). Monduzzi Editore, Bologna, Italy, 1996, 617-24- Cazzadori A, Di Perri G, Todeschini G, et al.
Transbronchial biopsy in the diagnosis of pulmonary infiltrates in the immunocompromised patients. Chest 1995; 107: 101-6- Jaffe JP, Maki DG.
Lung biopsy in the immunocompromised patients. Cancer 1981; 48: 1144-53- Crawford SW, Hackman RC, Clark GJ.
Open lung biopsy diagnosis of diffuse pulmonary infiltrates after marrow transplantation. Chest 1988; 94: 949-53- Bensard DD, McIntyre RC, Waring BJ, Simon SJ.
Comparison of videothoracoscopic lung biopsy to open lung biopsy in the diagnosis of interstitial lung disease. Chest 1993; 103: 765-70- Mouroux J, Meinesz CC, Padovani B, et al.
Efficacy and safety of videothoracoscopic lung biopsy in the diagnosis of interstitial lung disease. Eur J Cardiothorac Surg 1997; 11: 22-6- Çatalyürek H, Oto Ö.
İmmunsüprese hastalarda video eşliğinde torakoskopik cerrahi (VATS) uygulamaları. Uçan ES (Ed) Pnömoniler: Bir Devin Uyanışı, Saray Tıp Kitabevi, İzmir,1996,303-12- Bernard A
and the Thorax Group. Resection of pulmonary nodules using video-assisted thoracic surgery. Ann Thorac Surg 1996; 61: 202-5- Hennington MH, Ulicny KS, Detterbeck FC.
Vertical muscle sparing thoracotomy. Ann Thorac Surg 1994; 57: 759-61- Santambrogio L, Nosotti M, Bellaviti N, Mezzetti M.
Videothoracoscopy versus thoracotomy for the diagnosis of the indeterminate solitary pulmonary nodule. Ann Thorac Surg 1995; 59: 868-71- USPHS/IDSA Prevention of Opportunistic Infections Working Group.
1997 USPHS/IDSA Guidelines for the prevention of opportunistic infections in persons infected with HIV: Disease specific recommendations. Clin Infect Dis 1997; 25 (suppl 3): S313-S335- Türker A.
Hematopoietik büyüme faktöörleri kulanımı. Febril Nötropeni 1. Mezuniyet Sonrası Eğitim Kursu Kitabı. 22-23 Kasım 1997, Ankara- American Thoracic Society.
Treatment of tuberculosis and tuberculosis infection in adults and children. Am J Respir Crit Care Med 1994; 149: 1359-74- T.C. Sağlık Bakanlığı, Verem Danışma Kurulu.Tüberküloz Tedavisi Komisyonu raporu.
Toraks Bülteni 1996; 1(2): 36-9- Houston SH, Sinnott JT
Management of the transplant recipient with pulmonary infection. Infect Dis Clin North Am 1995; 9: 965-1003- Erdinç M, Erdinç E.
Toplum kökenli pnömonilerden korunma. Uçan ES (Ed) Pnömoniler: Bir Devin Uyanışı, Saray Tıp Kitabevi, İzmir, 1996, 41-59- Özacar R.
Hastane kökenli pnömonilerden korunma. Uçan ES (Ed) Pnömoniler: Bir Devin Uyanışı, Saray Tıp Kitabevi, İzmir, 1996, 107-27- Armitage JO.
Bone marrow transplantation. In: harrison’s Principles of Internal Medicine, 14th ed. Editors: Fauci, Braunwald, Isserbacher, Wilson, Martin, Kasper, Hansen, McGraw Hill Comp, New York, 1998; 724-730- Lyytikainen O, Ruutu T, Volin L, Lautenschlager I, Jokipii L, Tiittanen L, Ruutu P.
Late onset P. carinii pneumonia following allogeneic bone marrow transplantation 1996; 17: 1057-1059- Centers for Disease Control and Prevention.
Guideline for prevention of nosocomial pneumonia. Infect Control Hosp Epidemiol 1994; 15: 587-627- Farrugia E, Schwab TR.
Management and prevention of CMV infection after renal transplantation. Mayo Clin Proc 1992; 67: 879-90- Rubin RH, Tolkoff-Rubin NE.
Antimicrobial strategies in the care of organ transplant recipients. Antimicrob Agent Chemother 1993; 37: 619-24- Ettinger NA.
Solid organ and bone marrow transplantation. In: Respiratory Infections. Editors: Niederman MS, Sarosi GA, Glassroth J. WB Saunders Comp, Philadelphia,1994, 181-198- O’Donnell MR, Schmidt GM, Tegtmeier BR.
Prediction of systemic fungal infection in allogeneic marrow recipients: impact of amphotericin prophylaxis in high risk patients. J Clin Oncol 1994; 12: 827-34- Rowe JM, Ciobanu N, Ascensao J.
Recommended guidelines for the management of autologous an allogeneic bone marrow transplantation. Ann Intern Med 1994; 120: 143-58- Escamilla R, Hermant I.
Pneumonia in immunocompromised patients. Eur Respir Mon 1997; 3: 189-208- T.C. Sağlık Bakanlığı, Verem Danışma Kurulu .
Koruyucu Hizmetler Komisyonu raporu. Toraks Bülteni 1996; 1(2): 39-41